HIF-1 분해 항암제
-
배경 지식
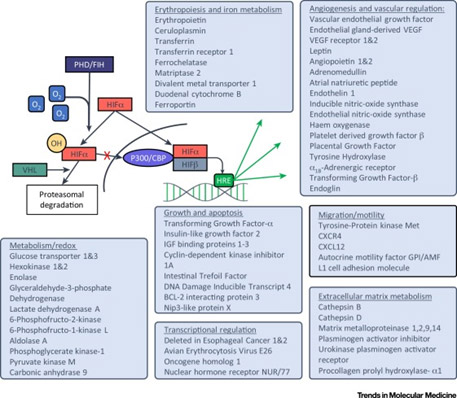
저산소 상태에서 HIF-1α의 발현양이 증가하여 암세포의 생존 및 전이 증가, 신생 혈관 생성 촉진, 암대사 활성화 등을 통해 암의 악성화를 유도함
-
표적암
폐암, 간암, 혈액암, 대장암, 췌장암 등
-
OCG-01-1564
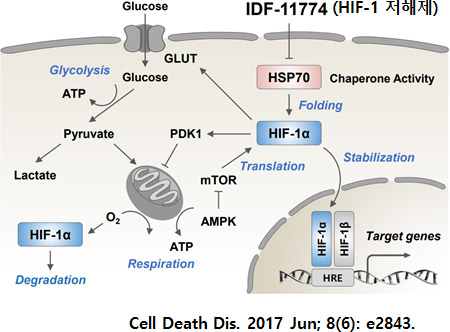
미토콘드리아 내의 호흡 전자전달계 복합체 기능을 억제함으로써 세포 내 HIF-1α 단백질의 분해를 촉진시켜 항암 효능을 나타냄 (Exp. Mol. Med. 52, 2020)
-
진행사항
최적화 단계
-
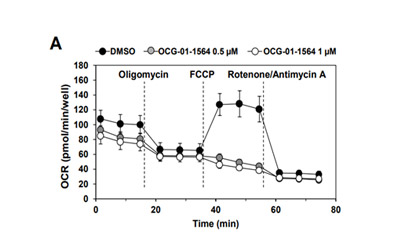 (A) 미토콘드리아 호흡 억제
(A) 미토콘드리아 호흡 억제 -
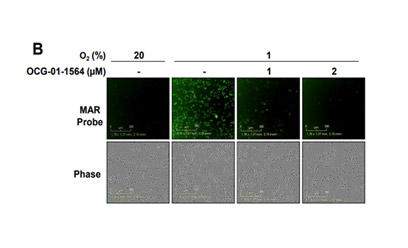 (B) 세포 내 산소량 증가
(B) 세포 내 산소량 증가 -
 (C) 약물에 의한 HIF-1α 양 감소
(C) 약물에 의한 HIF-1α 양 감소